Définition et exemples des ions spectateurs
 Share
Share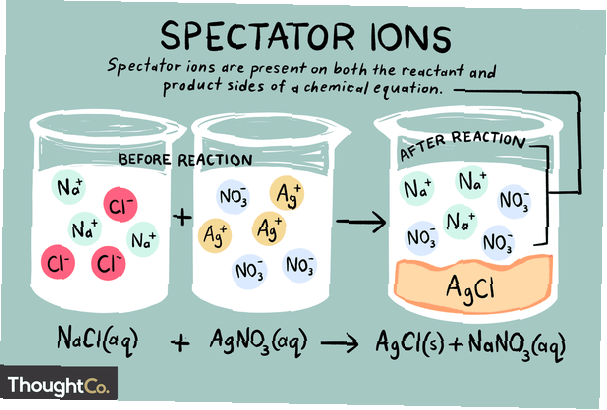
Les ions sont des atomes ou des molécules qui portent une charge électrique nette. Il existe différents types d'ions, notamment les cations, les anions et les ions spectateurs. Un ion spectateur est un ion qui existe sous la même forme à la fois du côté réactif et du côté produit d'une réaction chimique.
Définition de l'ion spectateur
Les ions spectateurs peuvent être soit des cations (ions chargés positivement) soit des anions (ions chargés négativement). L'ion est inchangé des deux côtés d'une équation chimique et n'affecte pas l'équilibre. Lors de l'écriture d'une équation ionique nette, les ions spectateurs trouvés dans l'équation d'origine sont ignorés. Ainsi, le total la réaction ionique est différente de la net réaction chimique.
Exemples d'ions spectateurs
Considérons la réaction entre le chlorure de sodium (NaCl) et le sulfate de cuivre (CuSO4) en solution aqueuse.
2 NaCl (aq) + CuSO4 (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (s)
La forme ionique de cette réaction est: 2 Na+ (aq) + 2 Cl- (aq) + Cu2+ (aq) + SO42- (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (s)
Les ions sodium et sulfate sont les ions spectateurs de cette réaction. Ils apparaissent inchangés à la fois du côté produit et côté réactif de l'équation. Ces ions «spectent» (regardent) tandis que les autres ions forment le chlorure de cuivre. Les ions spectateurs sont annulés d'une réaction lors de l'écriture de l'équation ionique nette, donc l'équation ionique nette pour cet exemple serait:
2 cl- (aq) + Cu2+ (aq) → CuCl2 (s)
Bien que les ions spectateurs soient ignorés dans la réaction nette, ils affectent la longueur de Debye.
Tableau des ions spectateurs communs
Ces ions sont des ions spectateurs car ils ne réagissent pas avec l'eau, donc lorsque les composés solubles de ces ions se dissolvent dans l'eau, ils n'affectent pas directement le pH et peuvent être ignorés. Bien que vous puissiez consulter un tableau, il vaut la peine de mémoriser les ions spectateurs courants, car les connaître facilite l'identification des acides forts, des bases fortes et des sels neutres dans une réaction chimique. La façon la plus simple de les apprendre est de former des groupes de trois ou trios d'ions réunis sur le tableau périodique des éléments.
