Que sont les acides et les bases?
 Share
Share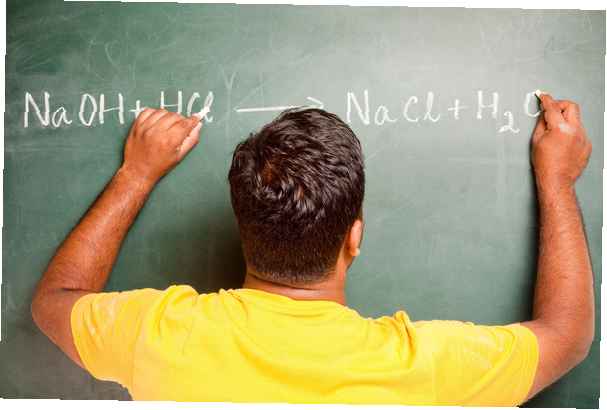
Il existe plusieurs méthodes pour définir les acides et les bases. Bien que ces définitions ne se contredisent pas, elles varient dans la mesure où elles sont inclusives. Les définitions les plus courantes des acides et des bases sont les acides et les bases d'Arrhenius, les acides et les bases de Brønsted-Lowry et les acides et les bases de Lewis. Antoine Lavoisier, Humphry Davy et Justus Liebig ont également fait des observations concernant les acides et les bases, mais n'ont pas formalisé les définitions.
Acides et bases Svante Arrhenius
La théorie d'Arrhenius sur les acides et les bases remonte à 1884, s'appuyant sur son observation que les sels, tels que le chlorure de sodium, se dissocient en ce qu'il a appelé des ions lorsqu'il est placé dans l'eau.
- les acides produisent H+ ions dans des solutions aqueuses
- les bases produisent OH- ions dans des solutions aqueuses
- eau requise, ne permet donc que des solutions aqueuses
- seuls les acides protiques sont autorisés; nécessaire pour produire des ions hydrogène
- seules les bases d'hydroxyde sont autorisées
Johannes Nicolaus Brønsted - Acides et bases de Thomas Martin Lowry
La théorie de Brønsted ou Brønsted-Lowry décrit les réactions acide-base comme un acide libérant un proton et une base acceptant un proton. Alors que la définition de l'acide est à peu près la même que celle proposée par Arrhenius (un ion hydrogène est un proton), la définition de ce qui constitue une base est beaucoup plus large.
- les acides sont des donneurs de protons
- les bases sont des accepteurs de protons
- les solutions aqueuses sont autorisées
- des bases en plus des hydroxydes sont autorisées
- seuls les acides protiques sont autorisés
Gilbert Newton Lewis Acids and Bases
La théorie de Lewis des acides et des bases est le modèle le moins restrictif. Il ne traite pas du tout des protons, mais traite exclusivement des paires d'électrons.
- les acides sont des accepteurs de paires d'électrons
- les bases sont des donneurs de paires d'électrons
- la moins restrictive des définitions acide-base
Propriétés des acides et des bases
Robert Boyle a décrit les qualités des acides et des bases en 1661. Ces caractéristiques peuvent être utilisées pour distinguer facilement les deux compositions chimiques sans effectuer des tests compliqués:
Les acides
- goût aigre (ne les goûtez pas!) - le mot «acide» vient du latin acere, ce qui signifie 'aigre'
- les acides sont corrosifs
- les acides changent le tournesol (un colorant végétal bleu) du bleu au rouge
- leurs solutions aqueuses (eau) conduisent un courant électrique (sont des électrolytes)
- réagir avec des bases pour former des sels et de l'eau
- dégager de l'hydrogène gazeux (H2) lors de la réaction avec un métal actif (comme les métaux alcalins, les métaux alcalino-terreux, le zinc, l'aluminium)
Acides communs
- acide citrique (à partir de certains fruits et légumes, notamment les agrumes)
- acide ascorbique (vitamine C, à partir de certains fruits)
- vinaigre (5% d'acide acétique)
- acide carbonique (pour la carbonatation des boissons gazeuses)
- acide lactique (dans le babeurre)
Bases
- goût amer (ne les goûtez pas!)
- vous vous sentez glissant ou savonneux (ne les touchez pas arbitrairement!)
- les bases ne changent pas la couleur du tournesol; ils peuvent redevenir bleu (acidifié) tournesol
- leurs solutions aqueuses (eau) conduisent un courant électrique (sont des électrolytes)
- réagir avec des acides pour former des sels et de l'eau
Bases communes
- détergents
- savon
- lessive (NaOH)
- ammoniac domestique (aqueux)
Acides et bases forts et faibles
La force des acides et des bases dépend de leur capacité à se dissocier ou à pénétrer leurs ions dans l'eau. Un acide fort ou une base forte se dissocie complètement (par exemple HCl ou NaOH), tandis qu'un acide faible ou une base faible ne se dissocie que partiellement (par exemple acide acétique).
La constante de dissociation acide et la constante de dissociation base indiquent la force relative d'un acide ou d'une base. La constante de dissociation acide Kune est la constante d'équilibre d'une dissociation acide-base:
HA + H2O ⇆ A- + H3O+
où HA est l'acide et A- est la base conjuguée.
Kune = [A-] [H3O+] / [HA] [H2O]
Ceci est utilisé pour calculer pKune, la constante logarithmique:
pkune = - journaldix Kune
Plus le pK est grandune plus la dissociation de l'acide est faible et plus l'acide est faible. Les acides forts ont un pKune de moins de -2.
