Molécules et grains de beauté en chimie
 Share
Share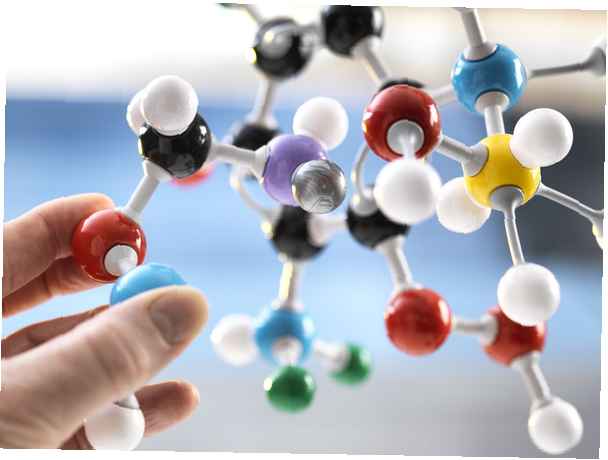
Les molécules et les taupes sont importantes à comprendre lorsque vous étudiez la chimie et les sciences physiques. Voici une explication de la signification de ces termes, de leur relation avec le nombre d'Avogadro et de leur utilisation pour trouver le poids moléculaire et le poids de la formule.
Molécules
Une molécule est une combinaison de deux ou plusieurs atomes qui sont maintenus ensemble par des liaisons chimiques, telles que des liaisons covalentes et des liaisons ioniques. Une molécule est la plus petite unité d'un composé qui affiche toujours les propriétés associées à ce composé. Les molécules peuvent contenir deux atomes du même élément, tels que O2 et H2, ou ils peuvent être constitués de deux ou plusieurs atomes différents, tels que CCl4 et H2O. Une espèce chimique constituée d'un seul atome ou ion n'est pas une molécule. Ainsi, par exemple, un atome H n'est pas une molécule, tandis que H2 et HCl sont des molécules. Dans l'étude de la chimie, les molécules sont généralement discutées en termes de poids moléculaire et de moles.
Un terme apparenté est un composé. En chimie, un composé est une molécule composée d'au moins deux types d'atomes différents. Tous les composés sont des molécules, mais toutes les molécules ne sont pas des composés! Les composés ioniques, tels que NaCl et KBr, ne forment pas de molécules discrètes traditionnelles comme celles formées par des liaisons covalentes. À l'état solide, ces substances forment un réseau tridimensionnel de particules chargées. Dans un tel cas, le poids moléculaire n'a pas de signification, donc le terme formule de poid est utilisé à la place.
Poids moléculaire et poids de la formule
Le poids moléculaire d'une molécule est calculé en ajoutant les poids atomiques (en unités de masse atomique ou amu) des atomes dans la molécule. Le poids de formule d'un composé ionique est calculé en ajoutant ses poids atomiques selon sa formule empirique.
La taupe
Une taupe est définie comme la quantité d'une substance qui a le même nombre de particules que dans 12 000 grammes de carbone 12. Ce nombre, le nombre d'Avogadro, est 6.022x1023. Le nombre d'Avogadro peut être appliqué à des atomes, des ions, des molécules, des composés, des éléphants, des bureaux ou tout autre objet. C'est juste un nombre pratique pour définir une taupe, ce qui permet aux chimistes de travailler plus facilement avec un très grand nombre d'articles.
La masse en grammes d'une mole d'un composé est égale au poids moléculaire du composé en unités de masse atomique. Une mole d'un composé contient 6.022x1023 molécules du composé. La masse d'une mole d'un composé est appelée son poids molaire ou masse molaire. Les unités de poids molaire ou de masse molaire sont des grammes par mole. Voici la formule pour déterminer le nombre de moles d'un échantillon:
mol = poids de l'échantillon (g) / poids molaire (g / mol)
Comment convertir des molécules en moles
La conversion entre les molécules et les taupes se fait soit en multipliant par, soit en divisant par le nombre d'Avogadro:
- Pour passer des taupes aux molécules, multipliez le nombre de taupes par 6,02 x 1023.
- Pour passer des molécules aux taupes, divisez le nombre de molécules par 6,02 x 1023.
Par exemple, si vous savez qu'il y a 3,35 x 1022 molécules d'eau dans un gramme d'eau et voulez savoir combien de moles d'eau il s'agit:
moles d'eau = molécules d'eau / nombre d'Avogadro
moles d'eau = 3,35 x 1022 / 6,02 x 1023
moles d'eau = 0,556 x 10-1 ou 0,056 mole dans 1 gramme d'eau
