Tableau périodique des éléments Faits sur le thorium
 Share
Share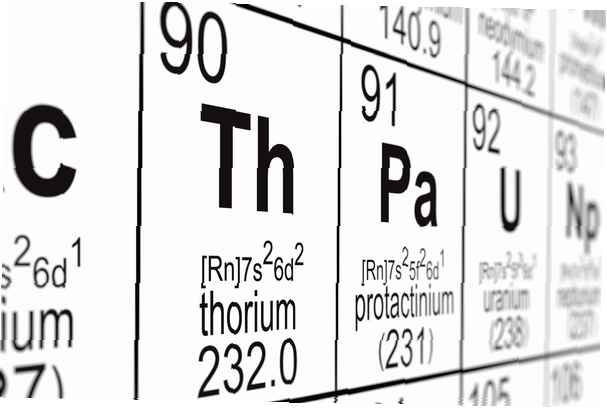
Numéro atomique: 90
Symbole: Th
Poids atomique: 232.0381
Découverte: Jons Jacob Berzelius 1828 (Suède)
Configuration électronique: [Rn] 6d2 7s2
Origine des mots: Nommé pour Thor, le dieu nordique de la guerre et du tonnerre
Isotopes: Tous les isotopes du thorium sont instables. Les masses atomiques varient de 223 à 234. Th-232 se produit naturellement, avec une demi-vie de 1,41 x 10dix ans. C'est un émetteur alpha qui passe par six étapes de désintégration alpha et quatre bêta pour devenir l'isotope stable Pb-208.
Propriétés: Le thorium a un point de fusion de 1750 ° C, un point d'ébullition ~ 4790 ° C, une gravité spécifique de 11,72, avec une valence de +4 et parfois +2 ou +3. Le thorium métallique pur est un blanc argenté stable à l'air qui peut conserver son éclat pendant des mois. Le thorium pur est doux, très ductile et peut être étiré, embouti et laminé à froid. Le thorium est dimorphe, passant d'une structure cubique à une structure cubique centrée sur le corps à 1400 ° C. Le point de fusion de l'oxyde de thorium est de 3300 ° C, qui est le point de fusion le plus élevé des oxydes. Le thorium est attaqué lentement par l'eau. Il ne se dissout pas facilement dans la plupart des acides, à l'exception de l'acide chlorhydrique. Le thorium contaminé par son oxyde va ternir lentement au gris et finalement au noir. Les propriétés physiques du métal dépendent fortement de la quantité d'oxyde présente. Le thorium en poudre est pyrophorique et doit être manipulé avec soin. Le chauffage des tournures de thorium dans l'air les fera s'enflammer et brûler avec une lumière blanche brillante. Le thorium se désintègre pour produire du radon, un émetteur alpha et un risque de rayonnement, de sorte que les zones où le thorium est stocké ou manipulé nécessitent une bonne ventilation.
Les usages: Le thorium est utilisé comme source d'énergie nucléaire. La chaleur interne de la terre est largement attribuée à la présence de thorium et d'uranium. Le thorium est également utilisé pour les lampes à gaz portables. Le thorium est allié au magnésium pour lui conférer une résistance au fluage et une résistance élevée à des températures élevées. La faible fonction de travail et l'émission élevée d'électrons rendent le thorium utile pour le revêtement de fil de tungstène utilisé dans les équipements électroniques. L'oxyde est utilisé pour fabriquer des creusets de laboratoire et du verre avec une faible dispersion et un indice de réfraction élevé. L'oxyde est également utilisé comme catalyseur dans la conversion de l'ammoniac en acide nitrique, dans la production d'acide sulfurique et dans le craquage du pétrole.
Sources: Le thorium se trouve dans la thorite (ThSiO4) et thorianite (ThO2 + UO2). Le thorium peut être récupéré de la monzonite, qui contient 3-9% de ThO2 associée à d'autres terres rares. Le thorium métal peut être obtenu en réduisant l'oxyde de thorium avec du calcium, par réduction du tétrachlorure de thorium avec un métal alcalin, par électrolyse du chlorure de thorium anhydre dans un mélange fondu de chlorures de potassium et de sodium, ou par réduction du tétrachlorure de thorium avec du chlorure de zinc anhydre.
Classification des éléments: Terre rare radioactive (actinide)
Données physiques sur le thorium
Densité (g / cc): 11,78
Point de fusion (K): 2028
Point d'ébullition (K): 5060
Apparence: métal gris, doux, malléable, ductile, radioactif
Rayon atomique (pm): 180
