Définition et faits du peroxyde
 Share
Share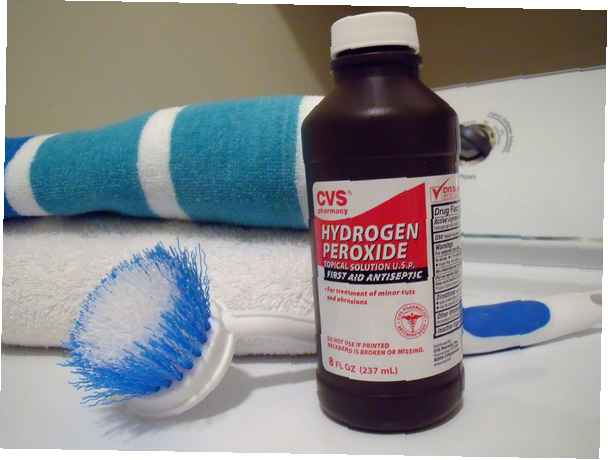
Un peroxyde est défini comme un anion polyatomique de formule moléculaire O22-. Les composés sont généralement classés comme ioniques ou covalents ou organiques ou inorganiques. Le groupe O-O est appelé groupe peroxo ou groupe peroxyde.
Le peroxyde fait également référence à tout composé contenant l'anion peroxyde.
Exemples de peroxydes
- Peroxyde d'hydrogène, H2O2, est un simple composé de peroxyde.
- D'autres peroxydes inorganiques (à part le peroxyde d'hydrogène) sont connus. Ceux-ci sont classés en tant que peroxydes ioniques ou peroxydes covalents. Les peroxydes ioniques contiennent comme ions des ions alcalins ou alcalino-terreux. Les peroxydes covalents comprennent le peroxyde d'hydrogène et également l'acide peroxymonosulfurique (H2DONC5).
- Techniquement, les superoxydes, les ozones, les ozonides et les dioxygényles sont des composés peroxydés, mais ils ont tendance à être considérés comme séparés en raison de leurs caractéristiques spéciales.
Présence et utilisations du peroxyde
- Les peroxydes se produisent naturellement en petites quantités dans les plantes et les animaux, l'eau et l'atmosphère. Chez l'homme et d'autres animaux, le peroxyde d'hydrogène est un sous-produit des réactions biochimiques. Le produit chimique est de courte durée mais est toxique pour les cellules en raison de sa capacité à oxyder l'ADN, les protéines et les lipides membranaires. Cette toxicité rend le peroxyde utile comme désinfectant pour tuer les bactéries et autres agents pathogènes. Cependant, presque toutes les cellules eucaryotes forment exprès du peroxyde dans des organites appelés peroxysomes. Les peroxysomes sont utilisés pour le catabolisme des acides gras, des acides aminés D et des polyamines et pour la biosynthèse de composés essentiels au fonctionnement normal des poumons et du cerveau.
- L'enzyme catalase utilise du peroxyde pour oxyder les substrats afin de neutraliser les toxines dans les cellules rénales et hépatiques. De cette façon, par exemple, les humains sont capables de métaboliser l'éthanol en acétaldéhyde.
- Les plantes utilisent du peroxyde d'hydrogène comme produit chimique de signalisation indiquant une défense contre les agents pathogènes.
- Certains peroxydes peuvent décolorer ou décolorer les molécules organiques, ils sont donc ajoutés aux agents nettoyants et aux colorants capillaires.
- Les peroxydes sont largement utilisés pour synthétiser des médicaments et d'autres produits chimiques.
- Le coléoptère bombardier stocke l'hydroquinone et le peroxyde d'hydrogène dans les réservoirs abdominaux. Lorsque le coléoptère est menacé, il mélange les produits chimiques ensemble, ce qui entraîne une réaction exothermique qui permet au coléoptère de gicler un liquide chaud et puant à une menace.
Manipulation sûre du peroxyde
La plupart des gens connaissent la solution domestique de peroxyde d'hydrogène, qui est une solution diluée de peroxyde d'hydrogène dans l'eau. Le type de peroxyde vendu pour la désinfection et le nettoyage est d'environ 3% de peroxyde dans l'eau. Lorsqu'elle est utilisée pour décolorer les cheveux, cette concentration est appelée V10. Des concentrations plus élevées peuvent être utilisées pour décolorer les cheveux ou pour le nettoyage industriel. Bien que le peroxyde domestique à 3% soit un produit chimique sûr, le peroxyde concentré est extrêmement dangereux!
Les peroxydes sont de puissants oxydants, capables de provoquer de graves brûlures chimiques.
Certains peroxydes organiques, tels que le TATP (triacétone triperoxyde) et HMTD (hexaméthylène triperoxyde diamine), sont hautement explosifs. Il est important de comprendre que ces composés très instables peuvent être produits par accident en mélangeant de l'acétone ou d'autres solvants cétoniques avec du peroxyde d'hydrogène. Pour cela, et pour d'autres raisons, il n'est pas judicieux de mélanger des peroxydes avec d'autres produits chimiques, sauf si vous avez une connaissance complète de la réaction qui en résulte..
Les composés peroxydiques doivent être stockés dans des conteneurs opaques, dans des endroits frais et exempts de vibrations. La chaleur et la lumière accélèrent les réactions chimiques avec les peroxydes et doivent être évitées.
