Définition de l'osmose en chimie
 Share
Share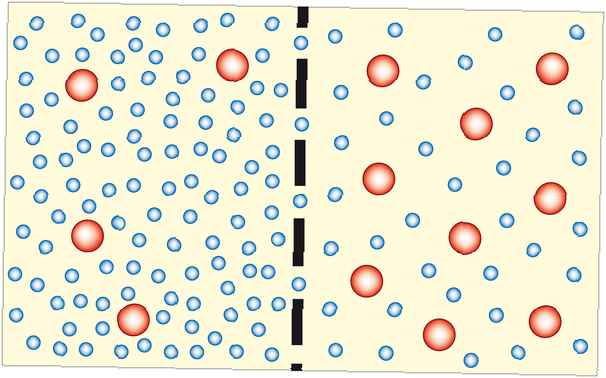
La diffusion et l'osmose sont deux processus importants de transport de masse en chimie et en biologie.
Définition de l'osmose
Osmose est le processus par lequel les molécules de solvant se déplacent à travers une membrane semi-perméable d'une solution diluée à une solution plus concentrée (qui devient plus diluée). Dans la plupart des cas, le solvant est de l'eau. Cependant, le solvant peut être un autre liquide ou même un gaz. L'osmose peut être faite pour faire du travail.
Histoire
Le phénomène d'osmose a été publié pour la première fois en 1748 par Jean-Antoine Nollet. Le terme «osmose» a été inventé par le médecin français René Joachim Henri Dutrochet, qui l'a dérivé des termes «endosmose» et «exosmose».
Comment fonctionne l'osmose
L'osmose agit pour égaliser la concentration des deux côtés d'une membrane. Étant donné que les particules de soluté sont incapables de traverser la membrane, c'est l'eau (ou un autre solvant) qui doit se déplacer. Plus le système se rapproche de l'équilibre, plus il devient stable, donc l'osmose est thermodynamiquement favorable.
Exemple d'osmose
Un bon exemple d'osmose est observé lorsque les globules rouges sont placés dans de l'eau douce. La membrane cellulaire des globules rouges est une membrane semi-perméable. La concentration d'ions et d'autres molécules de soluté est plus élevée à l'intérieur de la cellule qu'à l'extérieur, de sorte que l'eau pénètre dans la cellule par osmose. Cela fait gonfler les cellules. Comme la concentration ne peut pas atteindre l'équilibre, la quantité d'eau qui peut pénétrer dans la cellule est modérée par la pression de la membrane cellulaire agissant sur le contenu de la cellule. Souvent, la cellule absorbe plus d'eau que la membrane ne peut en supporter, provoquant l'éclatement de la cellule.
Un terme connexe est la pression osmotique. La pression osmotique est la pression externe qui devrait être appliquée de telle sorte qu'il n'y aurait pas de mouvement net de solvant à travers une membrane.
