Définition de la théorie de Valence Bond (VB)
 Share
Share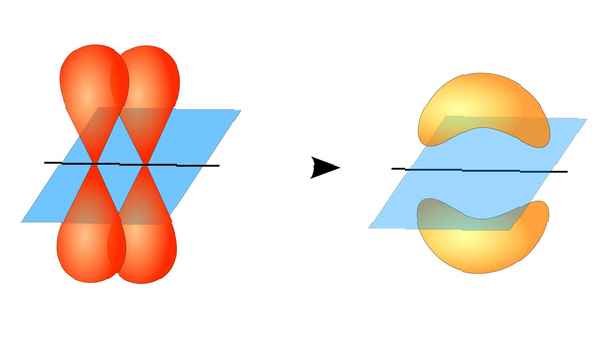
La théorie de la liaison de Valence (VB) est une théorie de liaison chimique qui explique la liaison chimique entre deux atomes. Comme la théorie de l'orbite moléculaire (MO), elle explique la liaison en utilisant les principes de la mécanique quantique. Selon la théorie de la liaison de valence, la liaison est causée par le chevauchement d'orbitales atomiques à moitié remplies. Les deux atomes partagent l'électron non apparié pour former une orbitale remplie pour former une orbitale hybride et se lier ensemble. Les liaisons Sigma et Pi font partie de la théorie des liaisons de valence.
Points clés: théorie de Valence Bond (VB)
- La théorie des liaisons de Valence ou théorie VB est une théorie basée sur la mécanique quantique qui explique le fonctionnement des liaisons chimiques.
- Dans la théorie des liaisons de valence, les orbitales atomiques des atomes individuels sont combinées pour former des liaisons chimiques.
- L'autre théorie majeure de la liaison chimique est la théorie orbitale moléculaire ou théorie MO.
- La théorie des liaisons de Valence est utilisée pour expliquer comment les liaisons chimiques covalentes se forment entre plusieurs molécules.
Théorie
La théorie des liaisons de Valence prédit la formation de liaisons covalentes entre les atomes lorsqu'ils ont des orbitales atomiques de valence à moitié remplies, contenant chacune un seul électron non apparié. Ces orbitales atomiques se chevauchent, donc les électrons ont la plus forte probabilité d'être dans la région de liaison. Les deux atomes partagent ensuite les électrons non appariés pour former des orbitales faiblement couplées.
Les deux orbitales atomiques n'ont pas besoin d'être identiques l'une à l'autre. Par exemple, les liaisons sigma et pi peuvent se chevaucher. Les liaisons sigma se forment lorsque les deux électrons partagés ont des orbitales qui se chevauchent tête à tête. En revanche, les liaisons pi se forment lorsque les orbitales se chevauchent mais sont parallèles les unes aux autres.
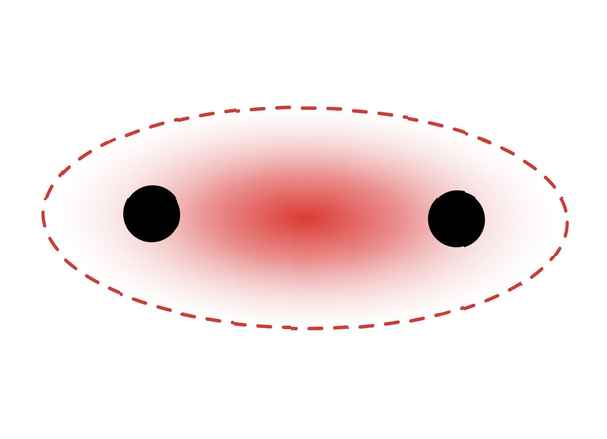 Ce diagramme représente une liaison sigma entre deux atomes. La zone rouge représente la densité électronique localisée. ZooFari / Creative Commons Attribution-Partage à l'identique 3.0 Licence non transférée
Ce diagramme représente une liaison sigma entre deux atomes. La zone rouge représente la densité électronique localisée. ZooFari / Creative Commons Attribution-Partage à l'identique 3.0 Licence non transférée Des liaisons sigma se forment entre les électrons de deux orbitales s car la forme orbitale est sphérique. Les liaisons simples contiennent une liaison sigma. Les doubles liaisons contiennent une liaison sigma et une liaison pi. Les liaisons triples contiennent une liaison sigma et deux liaisons pi. Lorsque des liaisons chimiques se forment entre les atomes, les orbitales atomiques peuvent être des hybrides de liaisons sigma et pi.
La théorie permet d'expliquer la formation de liaisons dans les cas où une structure de Lewis ne peut pas décrire un comportement réel. Dans ce cas, plusieurs structures de liaison de valence peuvent être utilisées pour décrire une seule restriction de Lewis.
Histoire
La théorie des liaisons de Valence s'inspire des structures de Lewis. G.N. Lewis a proposé ces structures en 1916, basé sur l'idée que deux électrons de liaison partagés formaient des liaisons chimiques. La mécanique quantique a été appliquée pour décrire les propriétés de liaison dans la théorie Heitler-Londres de 1927. Cette théorie décrivait la formation de liaisons chimiques entre les atomes d'hydrogène dans la molécule H2 en utilisant l'équation d'onde de Schrödinger pour fusionner les fonctions d'onde des deux atomes d'hydrogène. En 1928, Linus Pauling a combiné l'idée de liaison de paire de Lewis avec la théorie Heitler-London pour proposer la théorie de la liaison de valence. La théorie des liaisons de Valence a été développée pour décrire la résonance et l'hybridation orbitale. En 1931, Pauling a publié un article sur la théorie de la liaison de valence intitulé «Sur la nature de la liaison chimique». Les premiers programmes informatiques utilisés pour décrire la liaison chimique utilisaient la théorie orbitale moléculaire, mais depuis les années 1980, les principes de la théorie de la liaison de valence sont devenus programmables. Aujourd'hui, les versions modernes de ces théories sont en concurrence les unes avec les autres en termes de description précise du comportement réel.
Les usages
La théorie des liaisons de Valence peut souvent expliquer comment se forment les liaisons covalentes. La molécule de fluor diatomique, F2, est un exemple. Les atomes de fluor forment entre eux des liaisons covalentes uniques. La liaison F-F résulte du chevauchement pz orbitales, qui contiennent chacune un seul électron non apparié. Une situation similaire se produit dans l'hydrogène, H2, mais les longueurs de liaison et la résistance sont différentes entre H2 et F2 molécules. Une liaison covalente se forme entre l'hydrogène et le fluor dans l'acide fluorhydrique, HF. Cette liaison se forme à partir du chevauchement de l'hydrogène 1s orbital et le fluor 2pz orbital, qui ont chacun un électron non apparié. Dans HF, les atomes d'hydrogène et de fluor partagent ces électrons dans une liaison covalente.
Sources
- Cooper, David L .; Gerratt, Joseph; Raimondi, Mario (1986). "La structure électronique de la molécule de benzène." La nature. 323 (6090): 699. doi: 10.1038 / 323699a0
- Messmer, Richard P .; Schultz, Peter A. (1987). "La structure électronique de la molécule de benzène." La nature. 329 (6139): 492. doi: 10.1038 / 329492a0
- Murrell, J.N .; Kettle, S.F.A .; Tedder, J.M. (1985). Le lien chimique (2e éd.). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Structure électronique de la molécule de benzène." La nature. 325 (6103): 396. doi: 10.1038 / 325396d0
- Shaik, Sason S .; Phillipe C. Hiberty (2008). Guide du chimiste sur la théorie des obligations de Valence. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.
